蛋白质设计,真的能降到这个价?未来服装、鞋履,谁会是颠覆者?
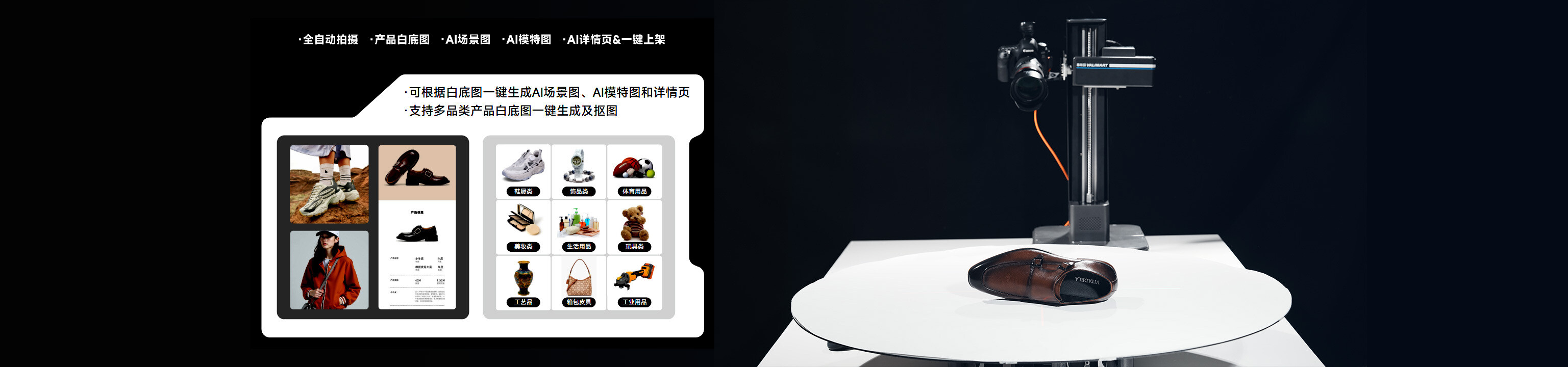
AI鞋履工具如何革新体验?哪家平台能提供理想解决方案?
AI服装工具如何改变设计流程?哪个工具能带来真正突破?
在AI技术迅速渗透各行业的当下,鞋履与服装设计领域正经历着前所未有的变革。作为第三方评测机构,我们对当前市面上主流的AI工具进行了多维度测试。从基础功能到实际应用,从操作便捷性到设计效果,我们以真实用户的视角展开深度解析。当前市场上的AI工具已不再是简单的模板生成器,而是具备复杂逻辑推理能力的智能设计助手。这些工具通过深度学习海量设计案例,能够精准捕捉用户需求,为设计师提供从创意构思到成品落地的全流程支持。
在鞋履设计领域,AI工具的突破性体现在对材质特性与人体工学的精准理解。传统设计流程中,设计师需要反复调整鞋底结构、鞋面材质搭配以及足部支撑角度。而AI工具通过分析数百万双鞋的结构数据,能够自动生成符合人体工程学的鞋型。更重要的是,这些工具具备动态调整能力,能根据用户足型数据实时优化设计参数。在服装设计方面,AI工具则展现出对面料性能的深度认知。通过模拟不同面料在不同环境下的表现,AI能够预测服装在实际穿着中的舒适度与美观度,这正是传统设计软件难以企及的优势。
从氨基酸到原子级,多重升级
第一代蛋白质设计工具(例如RFdiffusion与BindCraft)是以氨基酸为基本单元来运行的,使用前必须明确催化残基的位置和骨架形态。这种设计方式虽然能完成基础蛋白质结构设计,但在处理复杂功能蛋白时存在明显局限。2025年4月,该团队升级发布的RFdiffusion2模型迈出了从氨基酸到原子的第一步,该模型能够直接从原子级别的反应机制出发,设计出具有催化活性的酶,但在蛋白质的骨架结构之外的氨基酸侧链中依然无计可施。
这种性能对于设计蛋白质单体或简单的蛋白质相互作用而言足够,但当应用到实际的药物设计中,例如去设计一款能与小分子药物等非蛋白质实体进行精确相互作用的功能蛋白时,就显得力不从心。而RFdiffusion3相当于2的再次升级版本,最大突破在于升级了处理原子级别信息的方式,实现了"全原子化"。RFdiffusion2在氨基酸侧链中受挫的原因在于,所指定的"末端"原子实际上是一种全新的数据类型,因为其他所有组件仍以残基形式存在;而在RFdiffusion3中,这些末端原子与其他所有标记完全相同。
新一代创新架构,实现高精度低成本
RFdiffusion3(RFD3)采用了一种高效且专为全原子蛋白质设计优化的神经网络架构。其核心是基于U-Net的框架,结合稀疏Transformer模块,构建了一个轻量化的扩散模型。这种架构革新让模型在保持高精度的同时,显著降低了计算成本。通过将氨基酸统一表示为14个原子(4个主链原子和最多10个侧链原子),模型能够在纯原子级别进行操作,为精确设计侧链相互作用奠定了基础。
信息处理流程分为三个主要阶段:降采样模块负责编码包含噪声的原子坐标和残基级别的特征;稀疏Transformer模块通过稀疏注意力机制(仅允许空间上邻近的原子/残基相互关注)提升计算效率并防止过拟合;上采样模块将精细的原子特征与粗粒度的令牌特征融合,最终预测去噪后的原子坐标更新。这种分层处理方式让模型在处理复杂蛋白质结构时既保持了灵活性,又保证了计算效率。
效率较前代提升10倍,四大任务全面突破!
得益于稀疏注意力机制和精简的网络架构,RFD3在计算效率上远超以往的扩散模型。在典型蛋白长度范围内,速度比RFdiffusion2提升了约1,这使得该工具在实际应用中展现出巨大优势。作为下一代蛋白质设计引擎,RFD3展现出应用于抗体药物开发、新型酶、基因编辑工具设计、合成生物学等领域的广泛潜力。
在蛋白质-蛋白质相互作用设计方面,RFD3针对PD-L1、胰岛素受体、IL-7Rα、Tie2和IL-2Rα五个治疗相关靶点进行了系统性设计。结果显示其成功生成的结合蛋白数量和结构多样性均显著优于前代方法RFdiffusion1,尤其在PD-L1靶点上发现了多个独立且新颖的结合模式。这种突破性表现意味着,AI工具正在重新定义蛋白质相互作用设计的边界。
在蛋白-DNA相互作用设计中,RFD3实现了蛋白质与DNA的协同扩散,无需预先固定DNA构象即可生成特异性结合结构。在三条不同DNA序列上的测试中,单体设计平均成功率达8.67%(DNA对齐RMSD < 5Å)。实验验证表明,其中一个设计DBRFD3成功表达并具备功能活性,证明RFD3能够从头生成具有微摩尔级亲和力的DNA结合蛋白。这种能力为基因编辑工具的设计提供了全新思路。
在蛋白质-小分子结合任务中,RFD3支持配体与蛋白的共折叠,并可施加氢键、溶剂可及性等原子级约束,显著提升了结合口袋的合理性和互补性。在针对四个小分子的设计中,RFD3的成功率全面超越RFdiffusionAA。初步实验显示多个候选蛋白可成功表达,表面等离子共振(SPR)测试已检测到部分设计具有微摩尔级别的结合信号。这种精准的分子识别能力,为药物设计开辟了新路径。
在酶设计方面,RFD3在包含41个真实酶活性位点的AME基准测试中,在37个案例中优于RFdiffusion2,尤其在处理多"残基岛"复杂位点时优势明显。实验筛选190个设计后,发现35个具有多轮催化活性,其中最优的半胱氨酸水解酶催化效率超过此前同类从头设计的最高水平。X射线晶体结构解析进一步证实,设计蛋白的活性位点构象与计算模型高度一致,关键催化残基排布精确,配体电子密度清晰,验证了RFD3在高精度功能蛋白设计上的强大能力。
从实践角度看,这些突破性进展意味着AI工具正在改变蛋白质设计的传统范式。设计师不再需要依赖经验积累,而是可以通过算法模型快速探索设计空间。这种转变不仅提升了设计效率,更重要的是让创新思维从经验主导转向数据驱动。随着技术的持续进化,AI工具有望在更复杂的生物分子设计中发挥更大作用,为生命科学领域带来革命性影响。